
Kleine Einführung in die Photometrie
 | |||||||
Kleine Einführung in die Photometrie |
|||||||
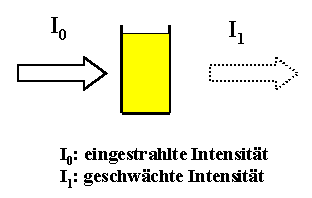
Als Photometrie bezeichnet man die Konzentrationsbestimmung einer Substanz, indem gemessen wird, wie sie die Intensität elektromagnetischer Strahlung schwächt. Der Begriff Photometrie ist auf den UV/VIS-Bereich beschränkt. | ||||||
 | ||||||
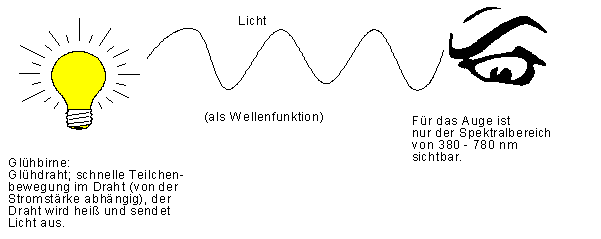
2. Elektromagnetische Strahlung (Zurück...) Im Folgenden wird der Versuch unternommen, den Begriff der elektromagnetischen Strahlung zu erklären. | ||||||
 | ||||||
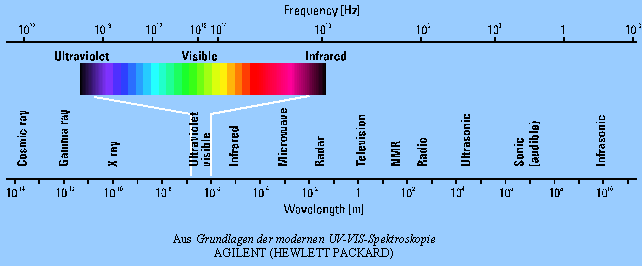
Wie klein dieser Anteil des elektromagnetischen Spektrums ist, den wir wahrnehmen, zeigt die nächste Grafik: | ||||||
 |
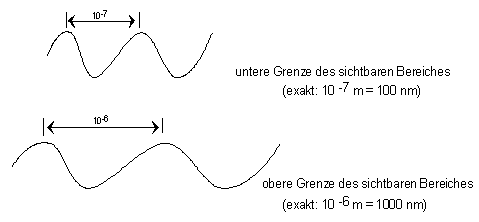
Licht, das von einem Glühdraht oder der Sonne ausgestrahlt wird, wird als weißes Licht bezeichnet. D. h., Licht ist elektromagnetische Strahlung im Wellenlängenbereich von 10-7 bis 10-6 m. |
||||||||||||||||||||||
 | ||||||||||||||||||||||
Trifft dieses Licht auf ein Prisma oder Gitter, wird es dispergiert. Als Dispersion wird das Zerlegen des Lichtes in seine Spektralfarben bezeichnet: | ||||||||||||||||||||||
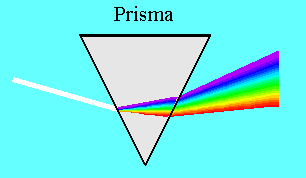 | ||||||||||||||||||||||
Warum tritt im Prisma Dispersion auf? Die Lichtgeschwindigkeit ist vom Medium (in diesem Fall das Glas des Prismas) abhängig und der Brechungindex von der Frequenz. An der
Grenzfläche Luft / Prisma wird das kurzwellige Licht (UV) stärker umgelenkt als das langwellige Licht (IR) und folglich tritt (Brechnungindex!) eine räumliche Trennung der Wellenlängen ein. | ||||||||||||||||||||||
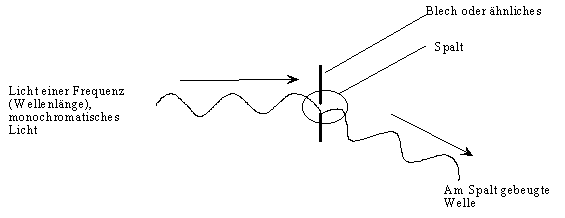 | ||||||||||||||||||||||
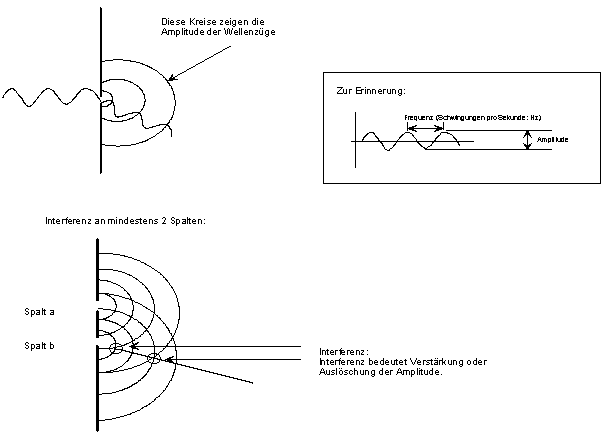
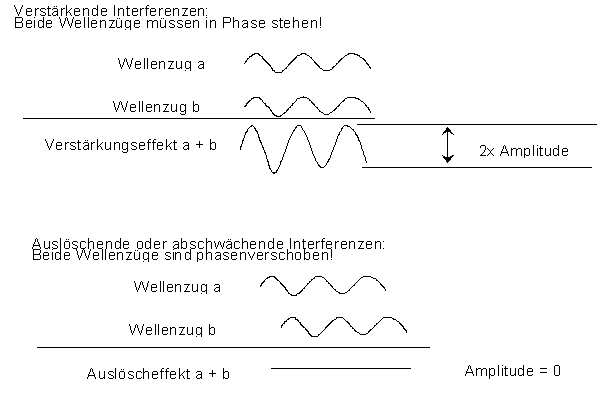
Die Lichtbeugung ist von der Frequenz abhängig. Wird das Licht durch mindestens zwei benachbarte Spalten geschickt, tritt Interferenz auf: | ||||||||||||||||||||||
 |
||||||||||||||||||||||
 | ||||||||||||||||||||||
Ein Gitter, wie es in der Spektroskopie eingesetzt wird, weist sehr viele dieser "Spalten" auf. Durch Drehung des Gitters wird die geforderte Wellenlänge eingestellt. Heute sind dies keine Spalten mehr, wie in den obigen Grafiken gezeigt, sondern sogenannte Sägezahnprofile auf einen Träger: | ||||||||||||||||||||||
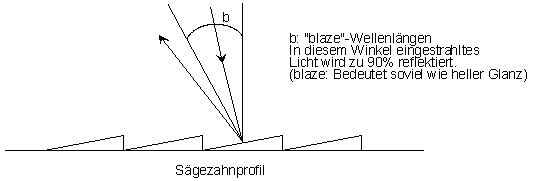 | ||||||||||||||||||||||
3. Intensitätsschwächung des Lichtes (Absorption) (Zurück...) Wir wissen nun, dass das sichtbare Licht nur den Bereich von 380 - 780 nm des elektromagnetischen Spektrums ausmacht. Weiterhin wissen wir, wie das Licht in seine Spektralfarben (einzelne Wellenlängen) zerlegt wird. In den folgenden Grafiken wird dargestellt, welche Vorgänge im Atom oder Molekül nach Absorption der Strahlung, in Abhängigkeit der Wellenlänge, ausgelöst werden. Was bedeutet Elektronenanregung? Elektronenanregung bedeutet, wenn die richtige Menge Energie (eine bestimmte Anzahl Energiequanten) von einer Substanz (z. B. chemische Verbindung) aufgenommen wird, verlässt das Elektron seinen Grundzustand und wechselt in einem höheren Zustand: | ||||||||||||||||||||||
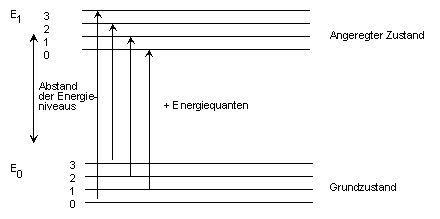 | ||||||||||||||||||||||
In diesen angeregten Zuständen verbleiben die Elektronen eine gewisse Zeit, z. B. bei 600 nm 2*10-15 Sekunden. | ||||||||||||||||||||||
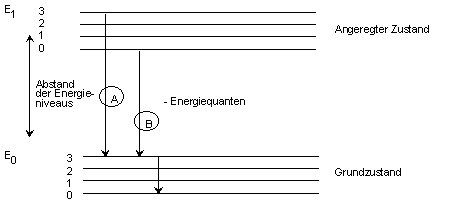 | ||||||||||||||||||||||
In der obigen Grafik sind 2 Vorgänge beschrieben; Vorgang A und B. Der Vorgang A stellt den Fall dar, indem die Energie, die zuvor aufgenommen wurde, nach Ablauf der Zeit im angeregten Zustand direkt wieder abgegeben wird. Vorgang B beschreibt den Fall, dass erst ein Energieniveau eingenommen wird, das nicht dem Ausgangsniveau entspricht. Dieses wird erst mit einer weiteren zeitlichen Verzögerung eingenommen. Diese Art der Abgabe der Energiequanten wird als Emission bei längeren Wellenlängen bezeichnet (Fluoresenz!). 4. Absorptionsspektrum (Zurück...) Wie bereits im Kapitel 3 erwähnt, absorbieren farbige Lösungen Licht bestimmter Wellenlängen. Eine blaue Lösung absorbiert die Wellenlängen um 580 nm, also gelbes Licht (blau ist die Komplementärfarbe von gelb). Folgende Tabelle gibt einen Überblick über die Farbe des Lichtes und seine Komplementärfarbe: | ||||||||||||||||||||||
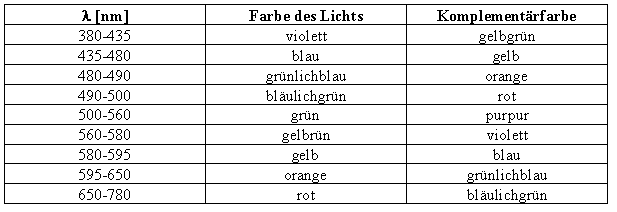 |
Schickt man gelbes Licht durch eine blaue Lösung, wird dieses mehr oder weniger in Abhängigkeit einiger weiterer Parameter absorbiert. Wird dieser Versuch nun mit blauem Licht wiederholt, stellen wir fest, dass kaum Licht absorbiert wurde. Wiederholungen mit weiteren Wellenlängen führen zum Absorptionsspektrum: |
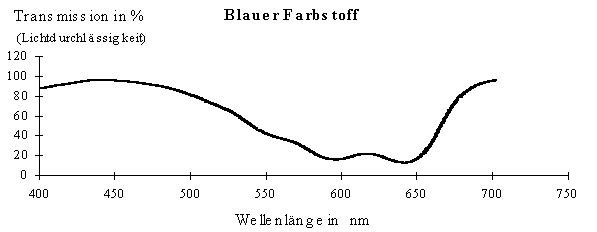 |
|
|
In der UV/VIS-Spektroskopie treten meist große Bereiche des Moleküls, besonders in konjugierten Systemen als absorbierend in Erscheinung. Das hat zur Folge, daß die Banden breit sind und sich häufig überlappen. |
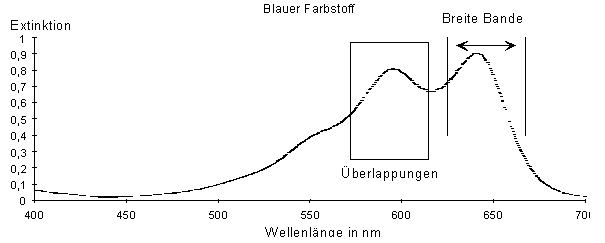 |
An dieser Stelle sei nur kurz erwähnt, daß empirische Regeln zur Strukturaufkärung aromatischer Carbonylverbindungen existieren (Woodwarschen Regeln). | |||||||||
5. Lambert-Beersche Gesetz (Zurück...) Im Kapitel 4 wurde darauf hingewiesen, dass Lichtabsorption beim Durchdringen einer farbigen Lösung von "einigen Parametern" abhängig ist. Die Herren Bouger (seine Mitarbeit wird meist unterschlagen), Lambert und Beer beschäftigten sich eingehend mit diesen Parametern und entdeckten Gesetzmäßigkeiten, die als das Gesetz von Bouguer-Lambert-Beer, kurz als Lambert-Beersches Gesetz bekannt wurden. | |||||||||
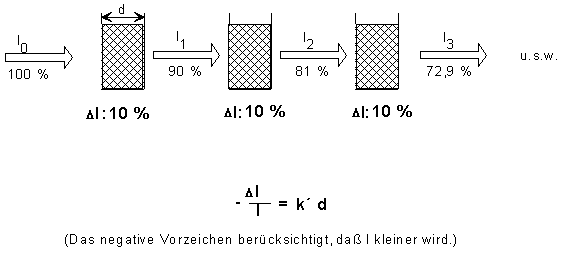 | |||||||||
Beer stellte fest, dass die relative Intensitätsabnahme proportional der Konzentration c der gelösten absorbierenden Substanz (in unserem Fall Farbstoff) ist: | |||||||||
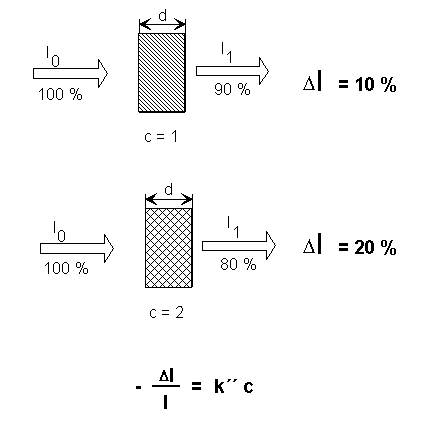 | |||||||||
An dieser Stelle wird für den Mathematik-Interessierten unter Ihnen kurz beschrieben, wie man zu der uns bekannten Form des Bouguer-Lambert-Beerschen-Gesetz gelangt: |
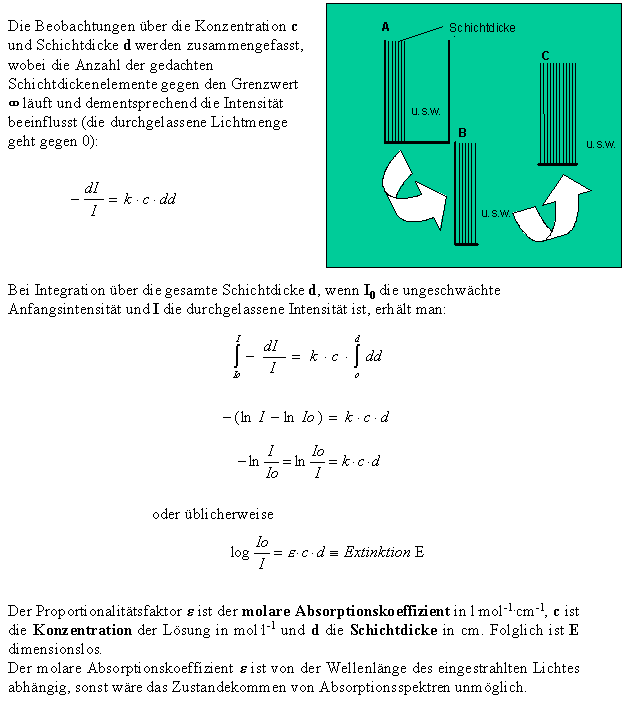 |
Hinweis: Häufig, besonders im Zusammenhang mit Messgeäten, wird auch als Kurzzeichen für die Extinkion A verwendet! |
Hat der Inhalt Ihnen weitergeholfen und Sie möchten diese Seiten unterstützen? |